Tipos de amostras, coleta, armazenamento e descarte de amostras
A coleta, o manuseio e o armazenamento adequados de amostras são pilares fundamentais para o funcionamento eficiente de um laboratório de análises clínicas. A integridade das amostras coletadas é crucial, pois quaisquer erros nesses processos podem comprometer significativamente a precisão dos resultados dos testes e, consequentemente, a qualidade do diagnóstico e do tratamento subsequente. Por isso, você como auxiliar de análises clínicas precisa estar afiado nesses processos.
Tipos de amostras
Em um laboratório de análises clínicas, uma variedade de amostras biológicas são coletadas e analisadas para diagnosticar, monitorar e tratar condições de saúde. Cada tipo de amostra pode fornecer informações valiosas sobre diferentes aspectos da saúde do paciente. Aqui estão alguns dos principais tipos de amostras trabalhadas nesses laboratórios:
Sangue
O sangue é uma das amostras mais comuns e informativas usadas em análises clínicas. Pode ser coletado através de uma punção venosa ou por meio de uma punção capilar (gotas de sangue). As análises de sangue podem incluir hemogramas completos, testes bioquímicos (como glicose, colesterol, funções renais e hepáticas), marcadores tumorais, testes hormonais, entre outros.
Urina
A análise de urina é utilizada para avaliar a função renal e detectar doenças do trato urinário, diabetes, e outras condições metabólicas. Testes comuns incluem urinálise (análise física, química e microscópica da urina) e cultura de urina para identificar infecções bacterianas.
Fezes
As amostras de fezes são analisadas para detectar infecções gastrointestinais, parasitas, sangramento oculto e para avaliar a função digestiva. Exames como a pesquisa de sangue oculto, coprocultura e análises parasitológicas são comumente realizados.
Secreções corporais
Incluem secreções como saliva, esputo (muco da respiração), secreções de feridas e fluidos sinoviais. Essas amostras são úteis para identificar patógenos infecciosos, células cancerosas ou inflamações.
Líquidos corporais
Amostras como líquido cefalorraquidiano (LCR), líquido pleural, líquido peritoneal, e líquido amniótico são coletadas para análises específicas que podem detectar infecções, sangramentos ou outras condições médicas.
Tecidos
Biopsias de tecidos são realizadas para examinar anormalidades que podem indicar processos inflamatórios, infecciosos ou cancerígenos. Amostras de tecido são frequentemente obtidas de tumores, pele, fígado ou pulmão. Além disso, amostras de pele e unhas são usadas para detectar infecções fúngicas, parasitárias ou outros problemas dermatológicos.
Coleta de amostras
O processo de coleta de amostras é o primeiro passo crítico no laboratório clínico. A técnica apropriada e a precisão na coleta são essenciais para garantir que a amostra seja representativa do estado fisiológico do paciente. Isso inclui a escolha do método e dos materiais de coleta adequados para cada tipo de amostra, sejam elas sangue, urina, tecidos, entre outros. A adoção de práticas padronizadas assegura a minimização de variáveis pré-analíticas que poderiam alterar os resultados dos testes. Abaixo, separamos para vocês como deve ser feita a coleta de amostras diferentes para que não haja prejuízos nos resultados.
Coleta de sangue
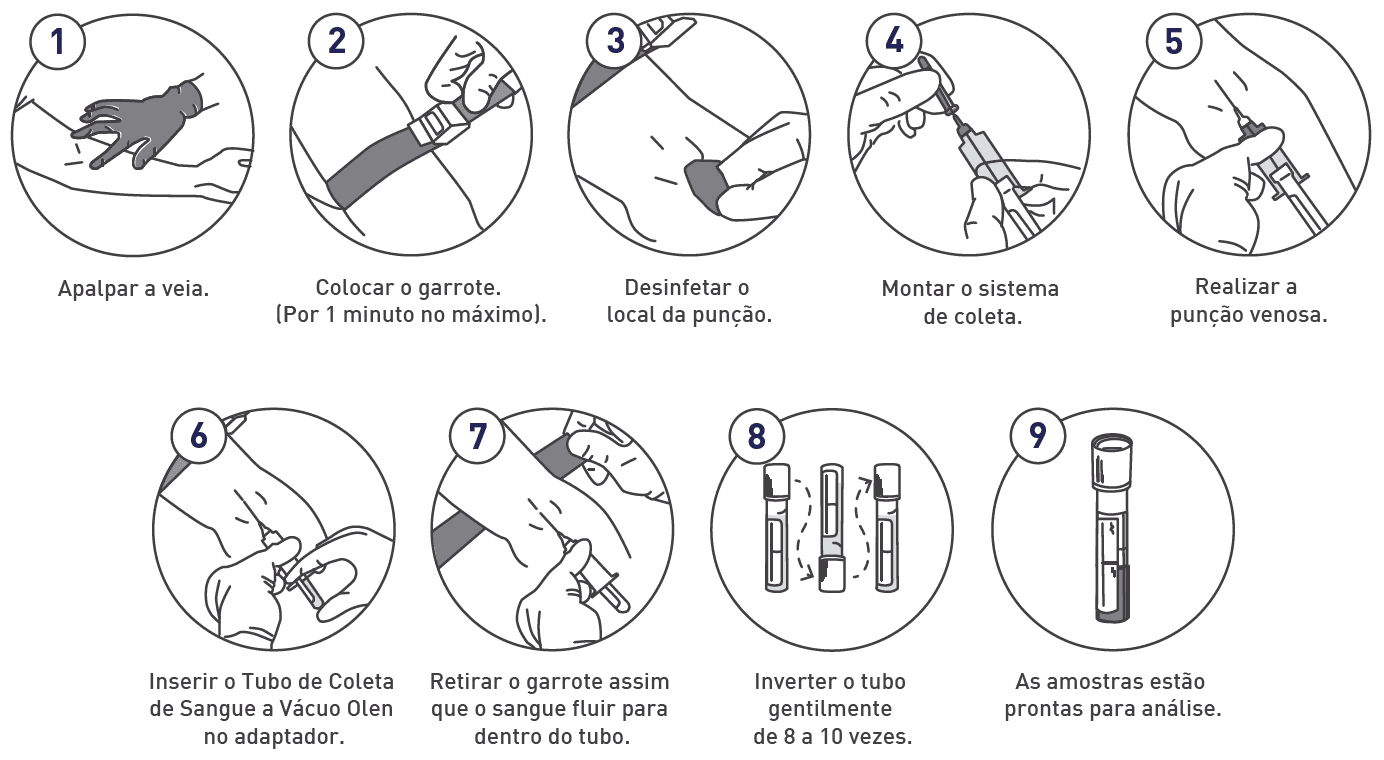
A coleta de sangue é uma etapa crítica que afeta diretamente a qualidade das análises clínicas. Este procedimento deve ser realizado com precisão para garantir a integridade das amostras e a precisão dos resultados. Segue um guia detalhado para a coleta eficiente de amostras de sangue:
Identificação e Preparação
- Verificação da Identificação: Confirme se os recipientes de coleta estão corretamente identificados;
- Comunicação com o Paciente: Explique claramente ao paciente o procedimento a ser realizado e apresente o kit de coleta;
- Consentimento: É essencial obter o consentimento do paciente por meio de um Termo de Consentimento Livre e Esclarecido;
- Informações sobre Resultados: Oriente o paciente sobre como e quando os resultados serão disponibilizados;
Procedimento de Coleta
- Posicionamento do Paciente: Assegure que o braço do paciente esteja confortável e acessível para a coleta segura;
- Higiene: Lave as mãos antes de iniciar o procedimento;
- Aplicação do Garrote: Coloque o garrote aproximadamente 8 cm acima da dobra do braço, cuidando para que não fique apertado por mais de um minuto para evitar hemólise e hemoconcentração.
Seleção da Veia e Antissepsia
- Escolha da Veia: Identifique a veia adequada para a punção, como a veia cefálica ou basílica;
- Antissepsia: Utilize um swab de álcool em movimento unidirecional sobre a área selecionada para garantir a limpeza. Repita se necessário.
Punção
- Preparação da Agulha: Retire a proteção da agulha;
- Técnica de Punção: Realize a punção com a agulha em um ângulo de 30º com o bisel voltado para cima, esticando a pele se necessário para melhor visualização da veia;
- Coleta de Amostras: Insira o tubo a vácuo e, assim que o sangue fluir, libere o garrote e peça ao paciente que abra a mão
Finalização
- Homogeneização: Inverta cada tubo coletado de 5 a 8 vezes para misturar o sangue com os aditivos e prevenir coagulação;
- Cuidados Pós-Coleta: Após retirar a agulha, aplique pressão no local da punção com algodão por 1 a 2 minutos, pedindo ao paciente que continue a pressão por mais alguns minutos para evitar hematomas;
- Curativo: Aplique um curativo oclusivo;
- Descarte de Materiais: Descarte a agulha e adaptador em um recipiente para materiais perfurocortantes.
Considerações Adicionais
- Homogeneização: A adequada homogeneização dos tubos é crucial para prevenir a formação de micro coágulos e garantir a qualidade das amostras;
- Volume de Sangue: É importante respeitar o volume de sangue especificado para cada tubo para evitar diluição ou problemas de coagulação.
Coleta de urina
Dado que a urina acumulada na bexiga é normalmente estéril, é vital aderir a procedimentos estandardizados para evitar a contaminação por bactérias da flora normal externa durante a coleta. Idealmente, a amostra de urina deve ser obtida no próprio laboratório e, quando possível, antes do paciente iniciar tratamento com antibióticos.
É recomendado que o paciente mantenha a urina na bexiga por pelo menos 2 horas antes da coleta, sendo 4 horas o período ideal para reduzir a probabilidade de resultados falso-negativos. Deve-se evitar a ingestão excessiva de líquidos, pois isso pode diluir a urina e afetar a contagem de colônias bacterianas, levando a possíveis resultados falso-negativos. É importante não coletar urina de dispositivos como comadres ou sacos coletores em pacientes com sonda.
É crucial que a urina não fique mais de 30 minutos à temperatura ambiente após a coleta. Se não for possível enviar imediatamente a amostra para o laboratório de microbiologia, ela deve ser refrigerada a uma temperatura entre 2 °C e 8 °C e pode ser conservada por no máximo 24 horas.
Em situações onde há atrasos no transporte, pode-se utilizar o laminocultivo nos postos de coleta. Esta técnica é prática, mas pode comprometer a quantificação exata de bactérias, sendo apropriado que o laboratório forneça um relatório qualitativo ou semiquantitativo da cultura.
Coleta de fezes
A coleta adequada de amostras fecais é essencial para a detecção e identificação de parasitos intestinais, que dependem da análise morfológica para determinar a espécie específica presente. Para obter resultados representativos, recomenda-se a coleta de fezes em dias não consecutivos, totalizando três amostras.
A amostra deve ser evacuada diretamente para um recipiente esterilizado ou sobre uma superfície limpa, como jornal ou papel higiênico, e depois cuidadosamente transferida para um frasco plástico com tampa de rosca. Lembrando que é de suma importância instruir ao paciente que as fezes coletadas não devem ter estado em contato com a área onde ocorreu a defecação e de maneira alguma é preciso encher o coletor, basta apenas um pedaço do tamanho do polegar.
Coleta microbiológica
As coletas microbiológicas são procedimentos críticos realizados em ambientes clínicos para identificar agentes patogênicos responsáveis por infecções. Estas amostras podem ser retiradas de diversas partes do corpo humano, onde microrganismos infecciosos podem estar presentes ou a infecção suspeitada. Devido à complexidade da flora microbiana normal presente em muitos destes locais, a técnica de coleta é fundamental para assegurar que os resultados dos testes sejam precisos e reflitam fielmente a condição patológica em análise.
Confira como deve ser feita a coleta para cada uma das regiões.
Para coletar amostras de secreções orofaríngeas eficazmente:
1. Instrua o paciente a abrir a boca amplamente;
2. Utilize um abaixador de língua para evitar contato com outras áreas da boca;
3. Com um swab estéril, colete material diretamente das amígdalas e da faringe posterior, locais onde patógenos respiratórios estão frequentemente presentes;
4. Evite tocar na língua, nas paredes da boca ou nos lábios para prevenir contaminação.
- Coleta em queimaduras e feridas
Em casos de queimaduras ou feridas abertas:
1. Prefira coletar biópsias de tecido profundo, pois a superfície muitas vezes está colonizada por flora não patogênica;
2. Assegure que a amostra venha de tecido viável e não de tecido necrosado ou contaminado superficialmente;
3. As biópsias proporcionam uma análise mais precisa da flora subjacente e da gravidade da infecção.
Para infecções do ouvido, especialmente em áreas médias ou internas:
1. Para o ouvido externo, remova secreção superficial com um swab umedecido em salina estéril e colete material mais profundo com um segundo swab;
2. Se houver suspeita de infecção do ouvido médio e a membrana timpânica estiver rompida, proceda com a coleta interna;
3. Use meio de transporte adequado para garantir a viabilidade das amostras durante o transporte para o laboratório.
Na coleta de secreções oculares:
1. Limpe e descarte qualquer secreção purulenta superficial;
2. Colete amostras da conjuntiva inferior, evitando contato com os cílios ou qualquer parte externa do olho que possa conter contaminantes;
3. Proceda rapidamente ao laboratório para processamento, para evitar a degradação do material.
- Secreções vaginais e endocervicais
Para amostras vaginais e endocervicais:
1. Garanta que a paciente não esteja menstruada e não tenha usado duchas ou produtos intravaginais recentemente;
2. Use um espéculo para visualizar o local da coleta e colete amostras do fundo vaginal e do canal endocervical com swabs específicos;
3. As amostras devem ser transportadas em meio adequado, especialmente se forem para cultura ou análise de patógenos específicos.
- Procedimento Geral para Todas as Coletas
1. Assegure práticas de antissepsia rigorosas antes da coleta para minimizar a contaminação;
2. Homogeneize os swabs no meio de transporte adequado, se aplicável;
3. Rotule corretamente todas as amostras com detalhes completos do paciente e da coleta.
Armazenamento de amostras
O armazenamento adequado de amostras clínicas é crucial para preservar a integridade e a validade dos resultados dos testes laboratoriais. O método de armazenamento depende do tipo de amostra e do propósito do teste. Então, vamos discutir as melhores práticas para garantir que as amostras sejam mantidas em condições ótimas.
Temperatura de Armazenamento
A maioria das amostras biológicas, incluindo sangue, urina, e algumas secreções, deve ser refrigerada se não for analisada imediatamente. A refrigeração é essencial para retardar processos biológicos que podem alterar os componentes da amostra.
Amostras destinadas a análises genéticas, algumas bioquímicas e armazenamento de longo prazo devem ser congeladas. O congelamento preserva os ácidos nucleicos e proteínas sensíveis. É crucial evitar ciclos repetidos de congelamento e descongelamento, que podem degradar a amostra.
Por fim, certas amostras, como swabs para cultura microbiológica, são mantidas em temperatura ambiente para evitar a morte de microorganismos sensíveis ao frio.
Contêineres apropriados
As amostras devem ser armazenadas em contêineres estéreis e à prova de vazamentos para evitar contaminação cruzada e perda de material.
Contêineres especiais com meio de transporte são usados para amostras microbiológicas para sustentar a viabilidade de microrganismos até que possam ser cultivados.
Uso de conservantes
Em certos casos, para a conservação de amostras como de urina e fezes, são adicionados conservantes para evitar a proliferação de bactérias e a degradação de substâncias químicas.
Para biópsias e tecidos, os fixadores como formol são usados para preservar a morfologia celular antes da análise histológica.
Etiquetagem e documentação
Cada amostra deve ser claramente etiquetada com informações como identificação do paciente, data e hora da coleta, tipo de amostra e condições de armazenamento específicas.
A documentação adequada deve acompanhar todas as amostras para rastrear sua origem, manipulação e armazenamento.
Monitoramento de condições de armazenamento
Equipamentos de armazenamento, como refrigeradores e freezers, devem ser monitorados e mantidos regularmente para garantir que estejam funcionando dentro das faixas de temperatura especificadas.
Em alguns laboratórios há uso de alarmes e sistemas de monitoramento remoto para garantir que as condições ideais sejam mantidas continuamente.
Limites de tempo
Cada tipo de amostra tem um limite de tempo para armazenamento após o qual seu teste pode não ser mais confiável. As equipes laboratoriais devem estar cientes desses limites e processar ou analisar amostras dentro dos prazos recomendados.
Seguindo estas diretrizes, laboratórios podem assegurar que as amostras clínicas sejam armazenadas de maneira que preserve sua integridade e utilidade para diagnósticos precisos e eficazes.
E para facilitar, separamos a ordem de prioridade que cada amostra possui, fique de olho e evite falhas!
Prioridade | Amostras | Tempo máximo para processamento | Motivo da Prioridade |
1 | Lavado broncoalveolar, Líquor, Amostras de cirurgias e líquidos estéreis | 20 minutos após recebidos | Alto risco de crescimento bacteriano e sepse se não processadas rapidamente. |
2 | Amostras de fezes sem conservantes | 30 minutos após coleta ou colocar em conservante ao chegar | Dessecação rápida do material dificulta análise. |
3 | Tecidos | 1 hora | Deterioração rápida do material se não processado logo após a coleta. |
4 | Outros líquidos (urina, secreções) | 1 hora | Crescimento bacteriano pode dificultar o diagnóstico. |
5 | Escarro e trato respiratório inferior | 1 hora a temperatura ambiente, 2 horas se refrigerada | Possível contaminação por bactérias da boca e nariz se não processadas logo. |
6 | Hemocultura | 4 horas a temperatura ambiente | Detecção precoce de bacteremia é crucial para o tratamento de infecções graves. |
7 | Swab | 8 horas | Diagnóstico rápido de infecções em locais de acesso fácil, como pele e mucosas. |
8 | Urina (refrigerada) | Até 24 horas | Crescimento bacteriano mais lento em baixas temperaturas. |
Descarte de amostras
O descarte de materiais biológicos em laboratórios de análises clínicas deve ser feito com muita cautela para evitar contaminação ambiental, propagação de infecções e riscos à saúde pública. Seguir protocolos estritos não apenas cumpre regulamentos legais, mas também protege sua saúde como também a de todos no laboratório e da comunidade. Aqui estão os passos essenciais para o descarte seguro de materiais biológicos.
Tratamento
Antes do descarte final, os resíduos biológicos frequentemente requerem tratamento para reduzir os riscos de infecção. Métodos comuns incluem:
Usada para esterilizar resíduos que contêm agentes biológicos. Este processo envolve exposição ao vapor sob alta pressão a temperaturas que destruirão todos os microrganismos.
É uma prática recomendada para resíduos que não podem ser autoclavados, como alguns tipos de resíduos patológicos (por exemplo, tecidos humanos).
Armazenamento seguro
Após a coleta e antes do tratamento final, os resíduos devem ser armazenados em uma área segura e designada dentro do laboratório ou em uma instalação externa. Essas áreas devem ser de acesso restrito para evitar exposição não autorizada.
Descarte final
Depois de tratados, os resíduos são removidos do laboratório por empresas especializadas em gestão de resíduos médicos e biológicos. Essas empresas devem estar em conformidade com todas as regulamentações ambientais e de saúde para o transporte e disposição final de resíduos perigosos.
Este artigo pertence ao Curso Auxiliar de Análises Clínicas
Curso GRÁTIS sem mensalidade, sem taxa de matrícula.

Bom curso irei me adapitar
Gostei muito.